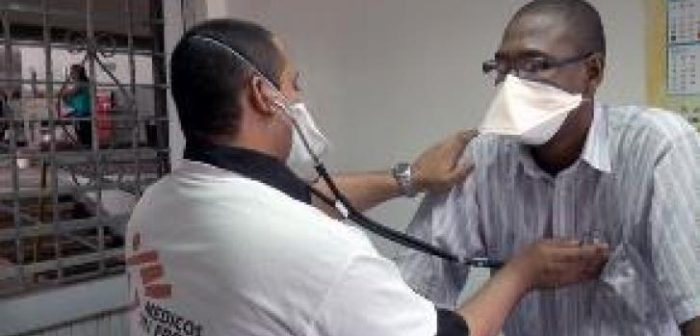
Las Organizaciones Internacionales Partners In Health (PIH), Médicos Sin Fronteras (MSF), Interactive Research and Development (IRD), así como su socio financiero UNITAID, iniciarán el próximo mes de abril el proyecto endTB, una asociación con la que se pretende cambiar radicalmente la gestión actual del tratamiento de la tuberculosis multirresistente (TB-MDR).
El objetivo inicial de endTB es que antes de 2019, 2.600 pacientes de 16 países hayan recibido los dos nuevos medicamentos (el bedaquiline y el delamanid) para tratar la enfermedad. Estas son los primeros fármacos desarrollados en más de cincuenta años contra la tuberculosis y ofrecen una nueva esperanza a los pacientes aquejados por TB-MDR, una enfermedad que hasta ahora terminaba con la vida del 50% de las personas que la desarrollaban.
EndTB usará los nuevos medicamentos siguiendo las recomendaciones de la OMS con un grupo de pacientes a los que se les hará un seguimiento muy pormenorizado. Además, 600 pacientes más formarán parte de un nuevo ensayo clínico para tratamientos de última generación. Si la investigación proporciona los resultados esperados y los tratamientos prueban ser seguros y efectivos, hará que estos regímenes más cortos y más fáciles de administrar se puedan calificar de revolucionarios.
Los dos nuevos medicamentos, pese haber sido aprobados para tratar la TB-MDR hace ya más de un año, apenas han sido distribuidos. El acceso a ellos en países con elevadas tasas de TB-MDR se ha realizado bajo programas de uso compasivo, lo que requiere una autorización caso por caso del productor a aquellos pacientes que se han quedado sin otras opciones.
Se estima que son menos de mil los pacientes que han recibido a día de hoy bedaquiline. Y el delamanid, que hasta ahora sólo se administra a través del uso compasivo, ya debería estar llegando a muchos más pacientes. La alianza endTB trabajará para que estos dos medicamentos estén accesibles para los cientos de miles de pacientes que sufren TB-MDR en todo el mundo.
«El principal obstáculo al día de hoy es que hay un conocimiento muy limitado de estos medicamentos. Muchos de los países en los que viven los pacientes más necesitados no están en posición para proporcionar el control de seguridad que se necesita para su uso”, explica el Dr Aamir Khan, coordinador de proyecto en IRD. “Por otro lado, el bedaquiline y el delamanid no han sido aún autorizados en la mayoría de los países. E incluso en los países donde se han registrado, los mecanismos para hacerlos llegar a los pacientes son demasiado complejos y burocráticos”.
Los tratamientos contra la tuberculosis que existen actualmente tienen una duración de seis meses y se administran en un cocktail de varios antibióticos. La TB-MDR se define como la resistencia de la bacteria de la TB a, al menos, dos de los antibióticos más potentes de primera línea: el rifampicin y el isoniazid. La más extrema forma de TB-MDR, conocida como extremadamente resistente (TB-XDR), ocurre cuando también existe resistencia a los medicamentos de segunda línea.
Del medio millón de personas que se estima que desarrollan TB-MDR cada año, alrededor del 10% son TB-XDR. En la actualidad, hay muy pocos medicamentos que sean eficaces para estos pacientes y tienen que ser combinados en tratamientos que se prolongan por dos años, con efectos secundarios severos, y que proporcionan una tasa de supervivencia de tan sólo el 50% para la TB-MDR y de alrededor del 20% para los pacientes con TB-XDR.
“Somos testigos cada día de cuán largos, dolorosos y poco efectivos son los tratamientos para los pacientes con tuberculosis resistente”, dice Michael Rich, coordinador del proyecto endTB en PIH. “Durante décadas hemos estado por detrás de la enfermedad, esperando nuevas herramientas para combatirla. Hoy tenemos una oportunidad de adelantarnos a la tuberculosis. Pero para poder hacerlo, tenemos que actuar rápidamente y delimitar un escenario en el que podamos hacer un uso efectivo y óptimo de los nuevos medicamentos”.
En países donde el bedaquiline ha sido accesible a los pacientes con TB-XDR por uso compasivo, los resultados han sido muy esperanzadores. En Armenia, por ejemplo, tras seis meses de tratamiento en un programa apoyado por MSF, el bacilo de la TB fue eliminado del esputo del 85% de los pacientes.
“Estos medicamentos suponen una nueva esperanza para los pacientes y para sus cuidadores. Pero los medicamentos sólo son una victoria a medias”, explica Francis Varaine, el coordinador del proyecto endTBde MSF. “Necesitamos más evidencias sobre la seguridad, eficacia y efectividad de los fármacos cuando se combinan con otros medicamentos, así como de la duración ideal del tratamiento y de los efectos secundarios asociados, entre otros parámetros. Sólo entonces podremos cambiar la tendencia negativa en la lucha contra la TB-MDR”.
“Este Proyecto ayudará a hacer el tratamiento de TB-MDR más efectivo y fácil de administrar, por lo que ayudará a detener la extensión de la enfermedad”, dice Lelio Marmora, director ejecutivo de UNITAID. “Esta nueva inversión es parte de nuestro trabajo para aportar innovaciones a la respuesta contra la TB. Estos nuevos fármacos son muy necesarios, y sirven para complementar las mejoras que se hicieron para la detección de la enfermedad en los últimos años y que han supuesto que el número de pacientes diagnosticados sea tres veces mayor desde 2.009”.
Información adicional sobre la sociedad endTB:
El Proyecto, que durará cuatro años, se iniciará el 1 de Abril. Fundado por UNITAID con un presupuesto de 60.4 millones de dólares, prevé llegar a un mínimo de 2.600 pacientes con TB-MDR de 16 países y garantizar que reciban los nuevos medicamentos (bedaquiline o delamanid). La lista completa de países en lso que se pondrá en marcha el programa es la siguiente: Armenia, Bangladesh, Bielorrusia, República Democrática de Corea, Etiopia, Georgia, Kazakstán, Kenia, Kirguizistán, India, Indonesia, Lesoto, Myanmar, Nepal, Pakistán y Perú. Cada paciente recibirá un seguimiento pormenorizado en su respuesta al tratamiento y a los posibles efectos adversos que puedan surgir.
Los ensayos clínicos se desarrollarán en cinco lugares (todavía en proceso de selección) y estudiarán la seguridad y eficacia de tratamientos más fáciles. En cada uno de ellos se probará un nuevo medicamento y los pacientes se enrolarán a finales de 2015. Los tratamientos que combinen bedaquiline y delamanid serán explorados en una siguiente fase, si otros estudios sugieren su combinación.
El Proyecto también reducirá las barreras existentes en diferentes países. Proveerá evidencias que servirán para facilitar el registro de los fármacos y abogará por una simplificación de los procedimientos. El proyecto fomentará una mayor base de evidencias para el desarrollo de recomendaciones de la OMS en el uso de nuevos fármacos.
Sobre el bedaquiline y el delamanid:
Bedaquiline (Sirturo™) y delamanid (Deltyba™) son los dos únicos medicamentos contra la TB desarrollados en los últimos cincuenta años. Han sido producidos por Janssen Pharmaceuticals y Otsuka Pharmaceutical, respectivamente. El Bedaquiline fue aprobado provisionalmente por la Food and Drug Administration (FDA) a finales de 2012, para el tratamiento de adultos con TB-MDR. Delamanid fue autorizada por la Agencia Europea del Medicamento (AEM) en Noviembre de 2013. Ambos han mostrado eficacia contra la TB en ensayos en fase II. La Fase III para Delamanid está actualmente en marcha.